
Amin là một nhóm các hợp chất hữu cơ quan trọng. Vậy amin là gì? Chia thành mấy loại và có những tính chất nào đặc trưng. Chúng ta hãy cùng nhau tìm hiểu thông qua bài viết dưới đây nhé!
1. Amin là gì?
Amin là hợp chất hữu cơ thay thế một hoặc nhiều nguyên tử hydro của phân tử amoniac (NH3). Vì vậy, N trong phân tử amin có thể 3 liên kết với các nhóm chức khác như alkyl, nhóm chức chứa Cacbon…
Amin cấu tạo nên protein - phân tử vô cùng quan trọng với các hoạt động sống đối với cơ thể.
2. Amin được phân thành mấy loại?
Có nhiều cách phân loại amin khác nhau như:
- Phân loại theo gốc liên kết:
- Amin thơm
- Amin béo:
- Amin dị vòng

- Phân loại theo bậc amin:
Trên cơ sở các nguyên tử hydro được thay thế bằng 1 phân tử amoniac, các amin được chia thành 4 loại chính dưới đây:
- Amin bậc 1: Khi một trong các nguyên tử hydro của phân tử amoniac được thay thế bằng 1 nhóm alkyl hoặc aryl. Ví dụ: Metylamin CH3NH2, Anilin C6H5NH2…
- Amin bậc 2: Hai nhóm thế hữu cơ thay thế cho 2 nguyên tử hydro trong phân tử amoniac tạo thành một amin.Ví dụ: Dimetylamin (CH3)2NH, Diphenylamine (C6H5)2 NH
- Amin bậc 3: Khi cả 3 nguyên tử hydro được thay thế bằng 3 nhóm thế hữu cơ như nhóm aryl hoặc thơm. Ví dụ: Trimetylamin N(CH3)3 , Axit etylendiaminetetraacetic (EDTA)...
Ngoài ra, khi amin liên kết với các vòng benzen, chúng còn được gọi là các amin thơm. Hợp chất đơn giản nhất của dãy amin thơm là anilin.
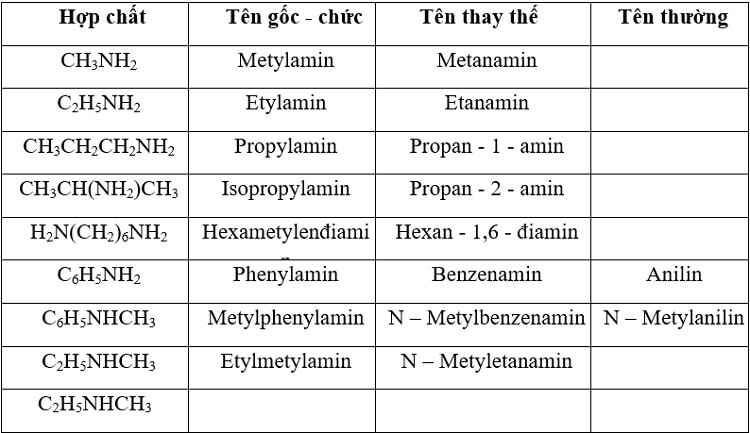
3. Cách gọi tên - danh pháp của amin
Amin có thể được gọi bằng nhiều tên khác nhau như sau:
3.1. Tên theo danh pháp gốc - chức
Tên amin = tên gốc alkyl + amin
Ví dụ như:
- CH3NH2 = methyl + amin = methylamin
- C2H5NH2 = etyl + amin = etylamin
3.2. Tên theo danh pháp thay thế
Tên amin = tên gốc alkyl + vị trí + amin
Ví dụ như:
- CH3CH(NH2)CH3 = propan - 2 - amin
3.3. Tên thường gọi
Ngoài các tên bên trên, amin còn được gọi bằng các tên thông thường như:
- C6H5NH2 = anilin
- C6H5NHCH3 = N-methylanilin
4. Tính chất đặc trưng của amin
4.1. Tính chất vật lý
- Về trạng thái tồn tại: Các amin có khối lượng thấp như metylamin và etylamin là những chất khí, có mùi gần giống amoniac. Còn các amin bậc cao hơn là những chất lỏng, có một số là chất rắn.
Cũng cần lưu ý rằng những alkyl amin và amin gốc hidrocacbonn mạch thẳng thường dễ bay hơi có mùi giống amoniac và rất độc. Chúng thường tồn tại trong các thịt cá và đây cũng chính là nguyên nhân khiến thực phẩm có mùi tanh ôi. Do đó để khử bớt các amin người ta thường dùng giấm hoặc chanh.
- Nhiệt độ sôi: Nhờ có sự phân cực và có mặt của hydro liên phân tử lên chúng có nhiệt độ cao hơn hydrocacbon tương ứng. Tuy nhiên, nhiệt độ sôi của chúng lại thấp hơn alcohol.
- Độ tan: Các amin thấp tan tốt trong nước, các amin có khối lượng cao ít tan hoặc không tan.
4.2. Tính chất hóa học
Tương tự như amoniac, amin thể hiện tính base do nguyên tử nitơ của amin có cặp electron độc thân nên chúng có khả năng nhường cặp electron để tạo thành bazơ. Tuy nhiên, đây là những base yếu.
- Chuyển màu xanh khi tác dụng lên giấy quỳ tím ẩm hoặc làm hồng phenolphtalein.
- Tác dụng với acid tạo ra muối amoni:
Vì amin là những base yếu nên các muối này dễ dàng tác dụng với base kiềm giải phóng amin nên sẽ tiếp tục phản ứng:
- Phản ứng với acid nito (HNO2, tuy nhiên không bền nên thường dùng hỗn hợp NaNO2 + HCl):
Amin bậc 1:
C2H5-NH2 + HONO -> C2H5-OH + N2 + H2O (xúc tác HCl)
Amin bậc 2:
(CH3)2N-H + HONO → (CH3)2N-N=O + H2O
C6H5-NH-CH3 + HONO → C6H5-N2O-CH3 + H2O
Amin bậc 3:
- Amin bậc 3 béo không tác dụng với axit nitrơ hoặc chỉ tạo thành muối không bền dễ bị thủy phân
- Amin bậc 3 thơm tác dụng với axit nitrơ cho sản phẩm thế ở nhân thơm. Ví dụ:
(CH3)2N-C6H5 + HONO → p-(CH3)2N-C6H4-NO + H2O (xúc tác axit HCl)
- Phản ứng thế gốc thơm:
Các nhóm -NH2, -NHCH3... là những nhóm hoạt hóa nhân thơm và có định hướng cho phản ứng thế xảy ra ở vị trí ortho và para.
- Halogen hóa: Anilin tác dụng với nước brom tạo thành kết tủa trắng 2,4,6-tribromoanilin
- Sunfo hóa: Đun nóng anilin với H2SO4 đậm đặc ở 180 độ C sẽ xảy ra một chuỗi phản ứng, cuối cùng tạo thành axit sunfanilic
Ngoài ra, Amin còn tham gia phản ứng thế nguyên tử hydro của nhóm amino.
5. Ứng dụng của amin trong đời sống
Amin được ứng dụng rộng rãi trong cuộc sống hàng ngày. Một số ứng dụng phổ biến của chúng như sau:
- Sử dụng trong lọc nước, sản xuất thuốc và phát triển thuốc trừ sâu và thuốc trừ sâu.
- Trong cơ thể sống, nó tham gia vào sản xuất acid amin - xây dựng lên protein quan trọng. Ngoài ra, amin cũng có thể tổng hợp thành vitamin.
- Các diamin được tổng hợp thành polyme.
- Các loại thuốc giảm đau như Morphine và Demerol được làm từ các amin.
- Dimetyl được dùng để sản xuất dung môi:
- Anilin được dùng nhiều trong công nghiệp phẩm nhuộm (phẩm azo, phẩm "đen anilin",...), dược phẩm (antifebrin, streptoxit, sunfaguaniđin,...), chất dẻo (anilin-fomanđehit,...)... Các toluidin và naphtylamin cũng được dùng trong sản xuất phẩm nhuộm
- Trong lĩnh vực sản xuất dược phẩm, các hợp chất amin được sử dụng để điều trị nhiều bệnh khác nhau như amphetamine chữa bệnh tăng huyết áp, chlorodiazepoxide có tác dụng an thần…

Trên đây là những kiến thức cơ bản về amin. Nhờ những tính chất đặc trưng, amin được sử dụng trong nhiều ngành nghề khác nhau đáp ứng các nhu cầu hàng ngày của con người.
Link nội dung: https://career.edu.vn/chat-nao-la-amin-bac-3-a29502.html